FDA査察を見据えた製造設備のデータインテグリティ対応

記事投稿:株式会社 日立産業制御ソリューションズ(2025.2.17更新)【PR記事】
FDA査察を見据えた製造設備のデータインテグリティ対応
1.FDA 査察 / Warning Lettersについて
近年、FDA(米国食品医薬品局)は製薬業界や医療機器業界に対する査察とWarning Letter(警告書)の発行を強化しています。COVID-19の影響で査察数がFY2020、FY2021で一時減少するも、COVID-19後に回復、リモート査察も拡大し、デジタルツールの活用が進んでいます。Warning Letterの発行も引き続き高い水準を維持しています。

出典:WL数(棒グラフ(赤))は、FDA WLサイトより(Warning Letters | FDA)
査察数(折れ線グラフ(緑))は、FDA Compliance Dashboardsより(FDA Dashboards - Compliance Dashboards)
Warning Letterが発行されると、企業は速やかな是正措置を報告する必要がありますが、改善が見られない場合、製品の市場撤退や販売停止などの深刻な結果を招く可能性があります。企業はコンプライアンス体制の見直しとデジタル技術を活用した品質管理の強化が求められます。
2.FDA Warning Lettersの最近の傾向
2024年におけるFDA(米国食品医薬品局)のWarning Letter(警告書)の発行には、いくつかの顕著な傾向が見られます。
特に製薬業界や医療機器業界において、「Data Integrity(以下、DI)」の問題やcGMP(Current Good Manufacturing Practice)の違反、サプライチェーンの管理不足などが主な指摘事項となっています。FDAは、製造プロセスの遵守や医薬品製造に関わるデータ、生データの正確性を強く求めており、データの虚偽報告や不正確な試験方法に対して厳格に対応しています。
3.DI 関連の Warning Letters
医薬品製造に関わるデータ、生データの信頼性を脅かす事例がグローバルで発生したことを契機に、2015年にDIに関するガイドラインが発行されました。最近のFDAのWarning Lettersにおける「DI」の事例をいくつかご紹介します。いずれの事例も「製造する医薬品の安全性、有効性、品質をサポートするためのデータの正確性と完全性を適切に保証していない」として指摘されています。

「https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters」から抜粋し日立産業制御ソリューションズが作成したものです。
4.製造業の情報システム階層モデルに基づく医薬品製造システムアーキテクチャ
製造業における情報システムの標準的なフレームワークであるISA-95階層モデルは、特に医薬品製造業において重要な役割を果たします。このモデルは、製造プロセスの効率化と品質管理の向上をめざして、企業内の異なるシステム間でのデータの整合性を確保します。
医薬品製造システムアーキテクチャは、4つの階層に分かれています。Level 1は「センシングと操作」で、製造装置や機器の直接的な制御を行います。Level 2は「監視と制御」で、プロセスデータの収集と制御を担当します。Level 3は「製造管理」で、生産計画や作業指示の管理を行います。Level 4は「経営管理」で、ERP(Enterprise Resource Planning)システムと連携し、企業全体のリソース管理や戦略的意思決定を支援します。
医薬品製造においては、品質管理や規制遵守が重要です。ISA-95階層を基にしたアーキテクチャは、製造過程のデータをリアルタイムで監視・管理することで、製品の品質を確保し、cGMP(Current Good Manufacturing Practice)やFDA規制などの遵守を支援します。これにより、製造効率の向上とともに、製品のトレーサビリティや監査対応が強化されます。

5.医薬品製造システムのトレンド
ISA-95階層モデルに基づく医薬品製造システムでは、デジタルトランスフォーメーションとインダストリー4.0が重要なトレンドとなっています。特に、IoT(モノのインターネット)やAI(人工知能)を活用したリアルタイムデータ分析が進んでおり、製造ラインの最適化や予知保全が実現されています。また、クラウドベースのシステム統合により、各階層間での情報共有がスムーズになり、規制遵守や品質管理が強化されています。さらに、生体認証技術を活用したセキュリティ強化と品質管理の向上も進んでいます。これらの技術革新は、医薬品製造業における効率化と信頼性を大きく向上させています。
6.「DI-PF」の概要ご紹介
上記4,5章で推奨した医薬品製造システムアーキテクチャを実現するために近年Level 2層にSCADAを導入することが増加しています。日立産業制御ソリューションズでは、工場IoT化推進を支援する新たな形のSCADAベースのPlatformとして、Data Integrity Platform(「DI-PF」)を開発・導入を行っています。本章では、「DI-PF」についてご紹介します。「DI-PF」とは、製造設備のDI対応とプラントデータ利活用の両面を1つのPlatformで実現しようというコンセプトで開発を行っています。「DI-PF」は大きく3つの特徴があります。
1つ目は、各設備のプロセス/ステータス/アラームデータなどのデータを収集し、プラントの運転状況を監視するものです。
2つ目は、上位システム(MES、Historianなど)連携により、ペーパーレス化を実現するものです。また、分析機器などの測定結果(CSV,pdfなど)を収集し、上位システムと連携することでもペーパーレス化を実現します。
3つ目は、各設備のDI対応機能で不足がある機能に対して、設備改造と「DI-PF」を導入することでDI対応機能を補完します。

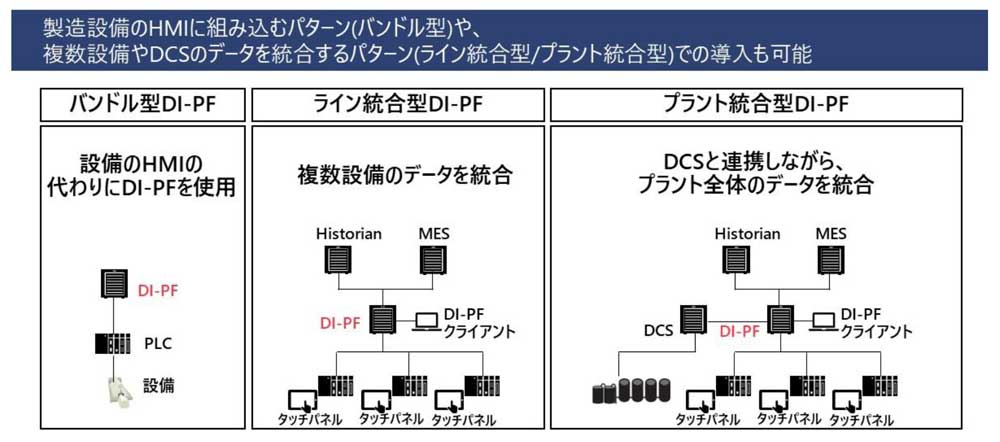
7.「DI-PF」の導入パターン
「DI-PF」の導入は大きく3パターンあります。
1つ目は、製造設備のHMIとして組み込むパターンでバンドル型といいます。
2つ目は、複数設備とデータ連携し、上位システムとのデータ垂直統合を実現するライン統合型といいます。
3つ目は、2つ目にDCS(distributed control system)のデータも統合するパターンでプラント統合型といいます。
これらのパターンは、製造現場のニーズや規模に応じて柔軟に選択され、システム間の連携を強化することが可能です。導入の際には、連携する製造設備やデータの内容によって範囲を定めて、具体的なシステムアーキテクチャを検討し、導入計画を立案します。
8.「DI-PF」の導入効果
「DI-PF」導入の効果は、製造現場、工場長、経営層の各ポジションにおける課題に応じてデータを正しく迅速に活用することで課題解決に結びつけ、以下の効果を発揮します。
経営層の課題に対しては、工場データを本社で見える化することにより、生産計画の見通しや安定供給体制の確保が可能となります。また、法規制への対応が厳格化する中で、監査対応の負担が軽減されます。
工場長の課題に対しては、工場全体のデータを集約することで、分析用データの準備が省力化され、製造記録のレビュー業務の効率化により高度な判断が可能となります。さらに、品質情報のロットトレース作業や適正な人材配置も効率的に行えるようになります。
現場の課題に対しては、製造記録のデジタル化により、記録作業の負荷が低減され、転記ミスや計算ミスによる手戻り作業が排除されます。これにより、付加価値作業へのシフトが進み、ペーパーレス化によるコスト削減が達成されます。

9.「DI-PF」構想策定支援サービスご紹介
「DI-PF」を導入するにあたり、「DI-PF」構想策定支援サービスの導入を推奨しています。「DI-PF」構想策定を実施し、対象となる設備やシステム連携を考慮し、システムアーキテクチャを検討します。具体的には、現状調査、要求・ルール整理、システム構成、バリデーション方針、スケジュール策定等を検討します。これらのコンセプトデザイン実施により、精緻なコスト算出と導入スケジュールを確定し、「DI-PF」のスムーズな導入に結びつけることが可能です。

■データインテグリティプラットフォーム「DI-PF」についての詳しくはウェブサイト をご覧ください。https://info.hitachi-ics.co.jp/product/di_pf/
■本製品のお問い合わせ先
株式会社 日立産業制御ソリューションズ
営業統括本部 産業営業本部 産業営業第三部 [担当:石塚]
電話:03-3251-7243(直通)


コメント
/
/
/
コメント